Катализатор – это вещество, которое ускоряет химическую реакцию, не расходуясь при этом. Он уменьшает энергию активации реакции, позволяя ей протекать при условиях, при которых она обычно происходит медленно или вообще не происходит. Катализаторы широко применяются в промышленности и в химических процессах как для синтеза новых веществ, так и для улучшения качества и экономии энергии в существующих процессах.
Требования к катализаторам:
Катализаторы играют важную роль в химических процессах, ускоряя их без изменения своих самих. Для обеспечения эффективности и долговечности катализаторов соблюдаются следующие требования:
1. Активность
Катализатор должен обладать высокой активностью, то есть способностью ускорять химическую реакцию без значительных потерь энергии. Чем выше активность катализатора, тем быстрее происходит реакция.
2. Селективность
Катализатор должен обладать селективностью, то есть способностью к специфическому ускорению определенной реакции, исключая или минимизируя побочные реакции. Это позволяет получить желаемый продукт с максимальной чистотой.
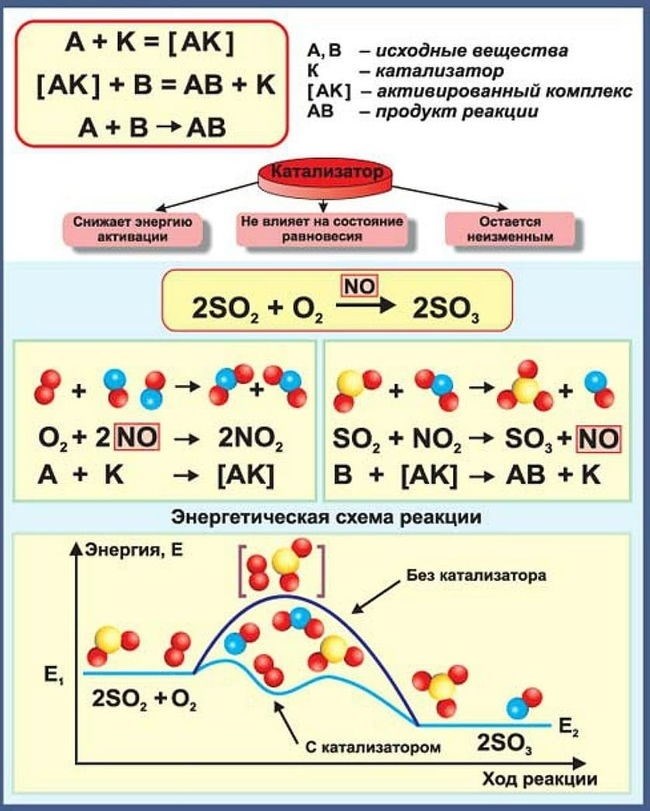
3. Стабильность
Катализатор должен быть стабильным, то есть способным сохранять свои каталитические свойства в течение длительного времени при повышенных температурах и в условиях высокого давления. Стабильность катализатора обеспечивает его долговечность и устойчивость к внешним воздействиям.
4. Регенерируемость
Катализатор должен быть регенерируемым, то есть способным восстанавливать свои каталитические свойства после использования или отравления. Регенерируемость катализатора позволяет его использовать повторно и снижает затраты на производство новых катализаторов.
5. Экономическая эффективность
Катализатор должен быть экономически эффективным, то есть обладать низкой стоимостью, чтобы его использование было выгоднее для производителей. Высокая эффективность катализатора способствует снижению затрат и повышению производительности.
6. Безопасность
Катализатор должен быть безопасным для использования и окружающей среды. Это включает в себя низкую токсичность, отсутствие опасных веществ и минимальное воздействие на окружающую среду в процессе применения и утилизации катализатора.
7. Качество
Катализатор должен соответствовать определенным стандартам качества, чтобы гарантировать его эффективность и безопасность использования. Качество катализатора включает в себя чистоту, однородность и стабильность его состава.
Некоторые из основных применений катализаторов:
1. Нефтепереработка
Катализаторы играют важную роль в нефтеперерабатывающей промышленности. Они используются для ускорения процессов гидроочистки нефтепродуктов, а также в процессе каталитического крекинга, при котором из более тяжелых фракций нефти получаются легкие нефтепродукты, такие как бензин и дизельное топливо.
2. Химическая промышленность
Катализаторы широко используются в химической промышленности для ускорения различных реакций. Например, они могут применяться в процессе производства аммиака, который является основным сырьем для производства удобрений. Также катализаторы применяются в процессах оксидации, гидрирования, дегидрирования и других реакциях.
3. Автомобильная промышленность
Катализаторы играют важную роль в снижении выбросов вредных веществ в атмосферу. Катализаторы, установленные на автомобилях, позволяют преобразовывать выбросы отработавших газов в менее вредные соединения. Это помогает снизить уровень загрязнения окружающей среды и сделать автомобили более экологически чистыми.
4. Фармацевтическая промышленность
Катализаторы используются в процессе производства лекарственных препаратов. Они помогают ускорить реакции и повысить эффективность процесса синтеза активных фармацевтических веществ. Кроме того, катализаторы используются и в процессе очистки фармацевтических продуктов от примесей.
5. Пищевая промышленность
Катализаторы также используются в пищевой промышленности. Например, они применяются для каталитической гидрирования растительных масел, что помогает получить продукты с желаемыми свойствами. Катализаторы также используются для различных процессов виноделия и пивоварения.
Разновидности веществ, ускоряющих химические реакции
Ускорители химических реакций, или катализаторы, представляют собой вещества, которые повышают скорость химической реакции, не вступая в нее непосредственно. Существует несколько разновидностей катализаторов, каждый из которых выполняет свою функцию и обладает своими особенностями.
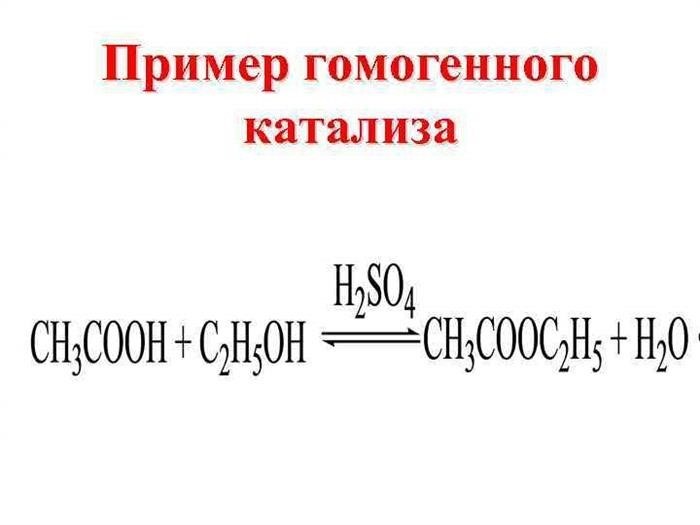
1. Гомогенные катализаторы
Гомогенные катализаторы – это вещества, которые находятся в одной фазе с реагентами. Они обычно представлены различными соединениями металлов и их соединений. Примерами гомогенных катализаторов являются комплексные соединения металлов, которые образуют растворы или газы. Такие катализаторы активизируют реакции путем образования активных промежуточных комплексов и участвуют в реакции в первоначальных стадиях.

2. Гетерогенные катализаторы
Гетерогенные катализаторы – это вещества, находящиеся в различных фазах с реагентами. Они обычно представлены поверхностями различных материалов, таких как металлы, оксиды и карбиды. Гетерогенные катализаторы активизируют реакции путем адсорбции реагентов на своей поверхности и последующего проведения химической реакции в активных центрах этих поверхностей.
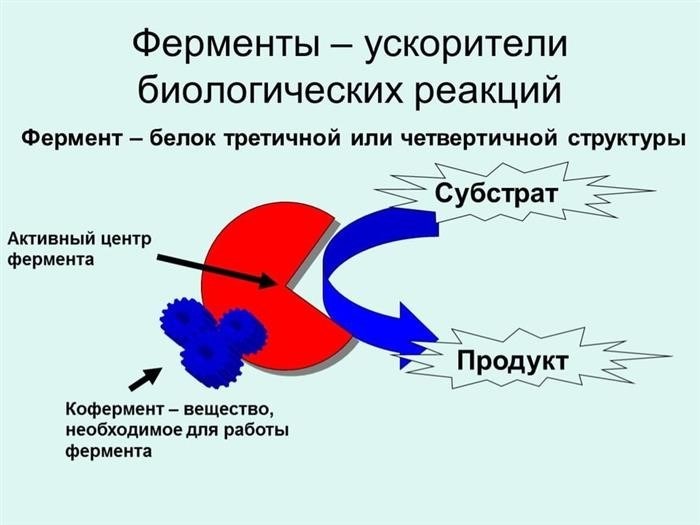
3. Ферменты
Ферменты – это биологические катализаторы, которые обычно представлены различными белками. Они присутствуют во всех живых организмах и участвуют в биохимических процессах. Ферменты обладают высокой специфичностью и эффективностью, и их действие основано на способности связываться с реагентами и образовывать активные места для проведения химических реакций.
4. Фотокатализаторы
Фотокатализаторы – это вещества, которые активизируют реакции с помощью светового излучения. Они обладают способностью поглощать световую энергию и использовать ее для инициирования и ускорения химических реакций. Фотокатализаторы находят применение в различных областях, таких как фотохимия, солнечная энергетика и фотокатализ в окружающей среде.
5. Энзимы
Энзимы – это специфические биокатализаторы, которые присутствуют в клетках всех живых организмов. Они играют ключевую роль в процессах обмена веществ. Энзимы обладают высокой активностью и специфичностью, и их действие основано на связывании субстрата и образовании комплекса, который затем претерпевает химическую реакцию.
Различные разновидности катализаторов имеют значительное значение в химических реакциях. Они способны повысить эффективность и экономичность процессов, а также обладают большим потенциалом в различных областях, включая промышленность, фармацевтику, сельское хозяйство и энергетику. Понимание и использование различных видов катализаторов является важным фактором в современной химии и науке в целом.
Зачем нужен катализатор в промышленности
Применение катализаторов в промышленности играет важную роль, так как они способны значительно ускорить химические реакции и повысить эффективность процессов производства. Катализаторы широко используются в различных отраслях промышленности, включая нефтеперерабатывающую, пищевую, фармацевтическую и химическую индустрии.
Основные функции катализатора в промышленности:
- Увеличение скорости реакции: катализаторы ускоряют протекание химических реакций, помогая им достигать равновесия быстрее. Благодаря этому, время производственного цикла сокращается, что позволяет снизить затраты на энергию и сырье.
- Повышение выхода продукта: катализаторы могут повысить конверсию и избирательность реакции, что приводит к увеличению количества получаемого продукта.
- Снижение температуры и давления: катализаторы позволяют проводить процессы при более низких температурах и давлениях, что ведет к снижению затрат на оборудование и энергию.
- Уменьшение отходов: катализаторы способствуют снижению образования побочных продуктов и отходов, что снижает экологическую нагрузку и повышает экономическую эффективность производства.
Примеры применения катализаторов в промышленности:
- Нефтехимическая промышленность: катализаторы используются при производстве бензина, дизельного топлива, пластиков, синтетических волокон и других нефтепродуктов.
- Фармацевтическая промышленность: катализаторы используются для синтеза различных лекарственных препаратов.
- Химическая промышленность: катализаторы применяются при производстве различных химических соединений, например, аммиака, синтетических смол, пестицидов, красителей и т.д.
- Пищевая промышленность: катализаторы используются при производстве пищевых добавок, ароматизаторов, крахмала и др.
Преимущества использования катализаторов в промышленности:
- Экономия времени и ресурсов: катализаторы позволяют сократить время процессов и потребление энергии и сырья.
- Улучшение качества продукции: использование катализаторов позволяет получать продукты с заданными характеристиками и высокой чистотой.
- Снижение вредных выбросов: эффективное использование катализаторов позволяет снизить выбросы вредных веществ и экологическую нагрузку на окружающую среду.
- Повышение эффективности производства: катализаторы позволяют увеличить выход продукции при одновременном снижении затрат и улучшении процессов.
Таким образом, катализаторы играют важную роль в промышленности, обеспечивая ускорение реакций, повышение выхода продукта, снижение затрат и улучшение качества производства.
Как работает катализатор?
Принципы работы катализатора:
- Адсорбция: Катализатор притягивает и удерживает молекулы реагентов на своей поверхности. Это позволяет увеличить концентрацию их вблизи активных центров катализатора и создает благоприятные условия для взаимодействия.
- Активация: Катализатор обеспечивает энергетический барьер для реакции ниже, чем без его участия. Он адсорбирует реагенты, изменяет их электронную структуру и образует промежуточные соединения, что способствует их более легкому и быстрому взаимодействию.
- Десорбция: После завершения реакции, катализатор отделяется от продуктов и возвращается в исходное состояние. Он может десорбировать продукты с поверхности или просто отпускать их в окружающую среду.
Примеры работы катализатора:
| Тип катализа | Пример реакции |
|---|---|
| Гетерогенный катализ | Окисление аммиака каталитическими никелевыми стержнями в промышленных условиях. |
| Гомогенный катализ | Процесс осаждения золотых наночастиц на поверхности коллоидных частиц в присутствии химических соединений золота. |
| Автокатализ | Реакция полимеризации этилена, при которой полимер выступает в роли катализатора для продолжения реакции. |
Катализаторы широко применяются в промышленности для производства различных химических веществ и материалов. Они позволяют сэкономить ресурсы и энергию, а также получить более чистые и высококачественные продукты.
Что такое катализатор реакции?
Одной из основных причин использования катализаторов является то, что они позволяют сэкономить энергию и ресурсы при проведении химических реакций. Катализаторы могут быть использованы для сокращения времени реакции, снижения температуры, необходимой для её запуска, а также для снижения количества используемых выходных материалов.
Катализаторы могут быть различных типов: гетерогенные и гомогенные. Гетерогенные катализаторы находятся в различных фазах с реакционной смесью, а гомогенные катализаторы находятся в одной фазе с реакционной смесью. Кроме того, катализаторы могут быть биологическими, ферментами.
Итак, катализатор реакции играет важную роль в химических процессах, позволяя ускорить реакцию или снизить требуемую энергию активации. Использование катализаторов может значительно повысить эффективность производственных процессов и сделать их более экологически безопасными.